Przez 4 miliardy lat ewolucja przetestowała więcej rozwiązań niż wszystkie laboratoria świata razem wzięte. Brytyjski startup Basecamp Research postanowił to wykorzystać: w styczniu 2026 roku zaprezentował EDEN – model AI trenowany na DNA z ponad miliona gatunków. W pierwszych testach 97% zaprojektowanych przez niego antybiotyków zadziałało na „superbakterie”, a narzędzia do edycji genów okazały się skuteczne w ponad 63% przypadków.
To zupełnie inne podejście niż dotychczasowe. Zamiast uczyć AI na danych z laboratoriów, naukowcy sięgnęli po metagenomy – surowe sekwencje DNA z gleby, oceanów, organizmów z 28 krajów. Model o 28 miliardach parametrów przeanalizował 9,7 biliona „liter” kodu genetycznego i nauczył się wzorców, których człowiek nigdy by nie zauważył.
Zastrzeżenie na start: EDEN generuje kandydatów na leki, nie gotowe terapie. Droga do apteki wciąż wymaga lat badań i setek milionów dolarów.
Dlaczego ewolucja wie więcej niż laboratoria?
Laboratoria mogą przetestować tylko ułamek możliwych cząsteczek. Ewolucja testowała je wszystkie – przez miliardy lat, na każdym kontynencie, w każdym środowisku. Problem polega na tym, że większość tych „eksperymentów natury” nigdy nie trafiła do baz danych.
Basecamp Research przez lata zbierał próbki DNA z miejsc, których nikt wcześniej systematycznie nie sekwencjonował: gorących źródeł, głębin oceanicznych, ekstremalnych środowisk. Efekt to BaseData – baza zawierająca ponad 10 miliardów genów z ponad miliona gatunków, z których większość nie ma nawet nazwy.
Model EDEN uczył się na tych danych wyłącznie. Żadnych struktur białek z laboratoriów, żadnych wyników badań klinicznych – tylko surowa ewolucja. Teza autorów: jeśli natura przez miliardy lat „wymyśliła” skuteczne antybiotyki i enzymy, to wzorce ich działania są zakodowane w sekwencjach DNA. Wystarczy je odczytać.
Antybiotyki projektowane przez AI: 97% zadziałało
Antybiotykooporność to jeden z największych kryzysów zdrowotnych XXI wieku. Według The Lancet (2024) już teraz zabija 1,27 miliona ludzi rocznie – więcej niż HIV/AIDS. Do 2050 roku może zabić 39 milionów. Tymczasem pipeline nowych antybiotyków jest „na skraju załamania”, bo firmy farmaceutyczne nie widzą w nich zysku.
EDEN podchodzi do problemu inaczej. Model nauczył się, jak wyglądają sekwencje DNA otaczające naturalne peptydy antybiotykowe – te, które bakterie i organizmy wytwarzają od miliardów lat. Następnie zaczął generować nowe, których natura nigdy nie stworzyła.
Wyniki pierwszych testów: spośród 33 wygenerowanych peptydów, 32 (97%) hamowały wzrost bakterii w laboratorium. Najlepsze kandydaty działały na patogeny z listy WHO o „krytycznym priorytecie” – w tym wielolekooporną Acinetobacter baumannii, która jest zmorą szpitali na całym świecie.
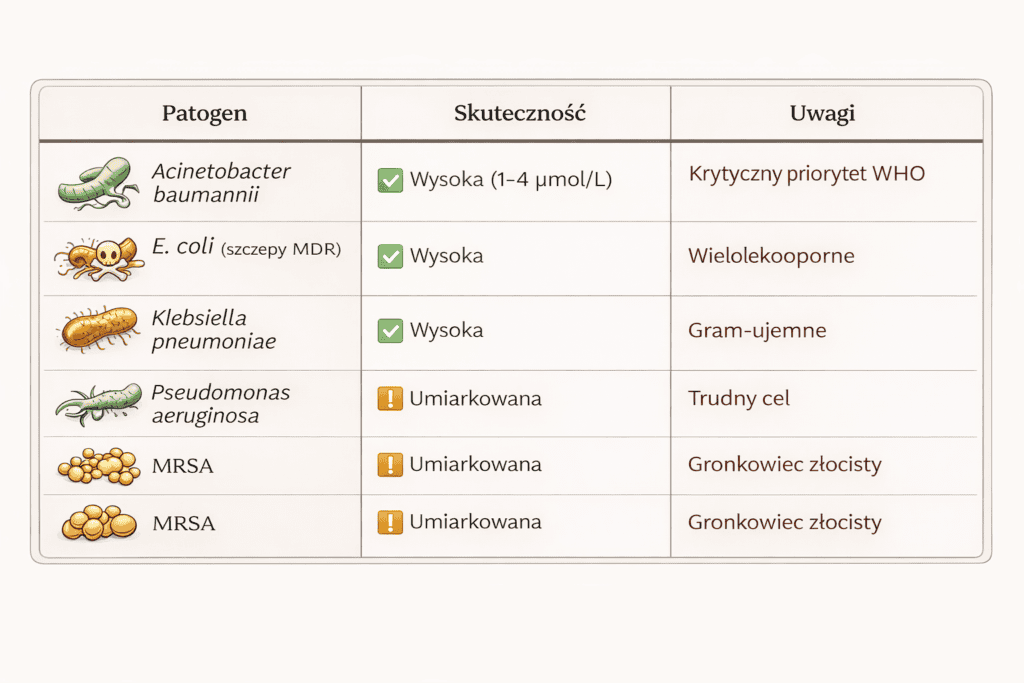
Źródło: Basecamp Research, 2026. n=33 peptydy.
Ale uwaga: 97% to imponująca liczba, ale dotyczy aktywności w probówce, nie skuteczności u pacjenta. Czy te peptydy są bezpieczne? Czy nie rozpadną się w organizmie? Czy nie wywołają reakcji immunologicznej? Tego jeszcze nie wiadomo. To kandydaci do dalszych badań, nie gotowe leki.
Edycja genów bez cięcia DNA
Drugim demonstratorem EDEN są rekombinazy LSR – enzymy, które potrafią wstawiać duże fragmenty DNA w genom bez cięcia podwójnej helisy. To istotne, bo obecny standard – CRISPR – działa właśnie przez cięcie, co niesie ryzyko nieplanowanych mutacji.
EDEN zaprojektował rekombinazy dla 10 genów związanych z chorobami (m.in. dystrofia mięśniowa, hemofilia) i 4 „bezpiecznych przystani” w genomie. Skuteczność: 63,2% wygenerowanych enzymów działało, gdy model dostał tylko 30 „liter” DNA jako wskazówkę.
Dla porównania: projektowanie takiego enzymu tradycyjnymi metodami to miesiące pracy i miliony dolarów. EDEN robi to w sekundy.
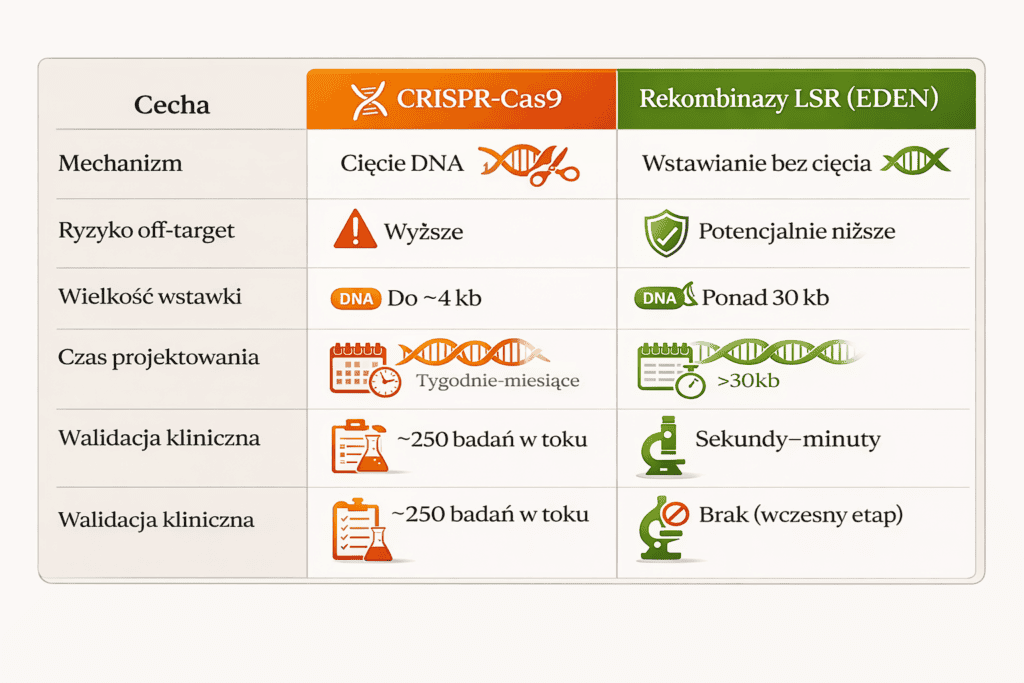
Źródła: Basecamp Research 2026, CRISPR Medicine News 2025.
Czego EDEN nie robi (i co może pójść nie tak)
Entuzjazm jest uzasadniony, ale trzeba zachować realizm.
EDEN to generator hipotez, nie fabryka leków. Model przyspiesza pierwszy etap – „co testować?” – ale nie zastępuje lat badań przedklinicznych i klinicznych. Historia AI w odkrywaniu leków jest pełna obietnic, które nie przełożyły się na zatwierdzone terapie.
97% i 63% to wyniki z małych prób. 33 peptydy i kilkadziesiąt rekombinaz to demonstracja koncepcji, nie dowód na skalę przemysłową. Jak te liczby wyglądają przy tysiącach kandydatów? Tego jeszcze nie wiemy.
Aktywność w laboratorium ≠ działanie u pacjenta. Peptydy mogą się rozkładać w organizmie, wywoływać reakcje immunologiczne, być toksyczne w wyższych dawkach. Wszystko to wymaga osobnych, kosztownych badań.
Model jest tak dobry jak dane. Jeśli BaseData ma luki (np. mało próbek z pewnych regionów), EDEN może generować stronnicze wyniki.
Dla kogo to ma znaczenie?
Firmy biotech z pustym pipeline: Jeśli wąskim gardłem jest „brak pomysłów co testować”, EDEN może być przełomem. Generuje kandydatów w tempie niemożliwym dla tradycyjnych metod.
Firmy z problemem translacji do kliniki: EDEN nie pomoże. Jeśli masz kandydatów, ale nie możesz ich przeprowadzić przez badania – model generuje więcej backlogu, nie wartości.
Zespoły bez wet-labu: Kandydaci z EDEN wymagają natychmiastowej walidacji laboratoryjnej. Bez infrastruktury do szybkiego testowania model jest bezużyteczny.

Podsumowanie
EDEN pokazuje, że AI może uczyć się bezpośrednio od ewolucji – i generować cząsteczki, których natura nigdy nie stworzyła, a człowiek by nie wymyślił. Liczby z pierwszych testów (97% aktywnych antybiotyków, 63% działających narzędzi genowych) są obiecujące, choć pochodzą z małych prób.
Najważniejsze pytanie brzmi: czy te kandydaci przejdą najtrudniejszy test – drogę do pacjenta? Na odpowiedź poczekamy lata. Ale jedno jest pewne: podejście „uczmy AI na ewolucji zamiast na laboratoriach” właśnie stało się poważną alternatywą dla tradycyjnego odkrywania leków.
Źródła
- Basecamp Research & NVIDIA, Designing AI-programmable therapeutics with the EDEN family of foundation models, styczeń 2026
- The Lancet, Global burden of bacterial antimicrobial resistance 1990–2021 with forecasts to 2050, wrzesień 2024
- WHO, Global Antimicrobial Resistance Surveillance Report, październik 2025
- CRISPR Medicine News, Overview CRISPR Clinical Trials, luty 2025
- Global Leaders Group on AMR, The antibiotic pipeline crisis, 2024


